国务院总理李克强于2020年12月21日主持召开国务院常务会议,指出医疗器械事关人民群众身体健康和生命安全,必须实行最严格的监管,应强化企业、研制机构对医疗器械安全性有效性的责任,明确审批、备案程序,增设产品唯一标识追溯、延伸检查等监管措施,加大监管和惩处力度,对涉及质量安全的严重违法行为大幅提高罚款数额,对严重违法单位及责任人采取吊销许可证、实行行业和市场禁入等严厉处罚,涉及犯罪的依法追究刑事责任。
在2021年2月9日发布并自2021年6月1日正式生效的修订后《医疗器械监督管理条例》(国务院令第739号)(下称《条例》)第三十八条规定:“国家根据医疗器械产品类别,分步实施医疗器械唯一标识制度,实现医疗器械可追溯,具体办法由国务院药品监督管理部门会同国务院有关部门制定。”
至此,医疗器械唯一标识UDI(unique device identifier)追溯正式纳入国家行政法规层面。本文将介绍UDI相关制度、法规,并结合近期拟上市企业关于医疗器械产品全流程追溯制度的关注问题来介绍说明其在实践中的应用。
什么是医疗器械唯一标识?
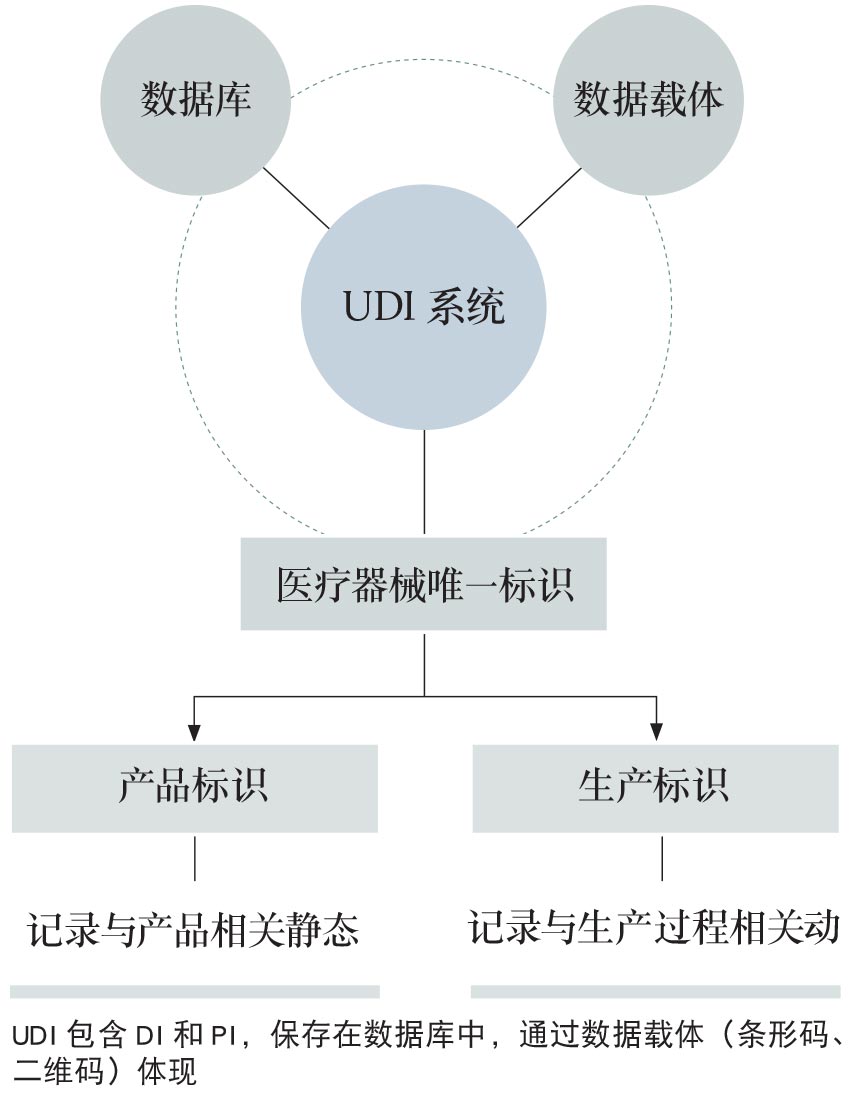
医疗器械唯一标识用于产品识别,相当于医疗器械的“身份证”,由产品标识(DI)和生产标识(PI)组成。产品标识是识别注册人/备案人、医疗器械型号规格和包装的唯一代码,是从数据库获取医疗器械相关信息的“关键字”,也是唯一标识的必须部分。生产标识包括与生产过程相关的信息,包括产品批号、序列号、生产日期和失效日期等,可与产品标识联合使用,满足医疗器械流通和使用环节精细化识别和记录的需求。
立法背景
根据国家药监局于2019年10月发布的《医疗器械唯一标识系统规则》(UDI规则)解读,近年来,医疗器械产业发展迅猛,新技术、新产品层出不穷,产品多样性、复杂性程度不断提升,医疗器械在流通使用环节无码或者一械多码现象普遍,严重影响了医疗器械生产、流通、使用等各环节对医疗器械的精准识别,难以实现有效监督和管理。实现生产、经营、使用各环节的可视化,提升产品的可追溯性,是医疗器械监管手段创新和监管效能提升的重要抓手,对医疗器械质量安全、助力医疗器械产业高质量发展将起到积极作用。

合伙人
竞天公诚律师事务所
国际上,国际医疗器械监管机构论坛(IMDRF)于2013年发布医疗器械唯一标识系统指南。同年,美国发布医疗器械唯一标识系统法规。2017年,欧盟立法要求实施医疗器械唯一标识,日本、澳大利亚、阿根廷等国家也相继开展相关工作。美国是首个在国家层面、由联邦政府以法规形式实施医疗器械唯一标识系统项目的国家,FDA自2013年起先后发布《医疗器械追溯要求》(Medical Device Tracking Requirements)等一系列UDI合规要求,规范医疗器械生产企业实施对二类、三类医疗器械的从出厂到患者的全流程追溯。医疗器械生产企业作为医疗器械追溯制度项下的第一责任人,各级经销商也应当承担医疗器械追溯制度项下责任。
2017年5月欧盟出台的医疗器械条例新政(Medical Device Regulation EU 2017/745)于2021年5月正式实施,其中第27条、28条要求根据国际标准建立医疗器械唯一标识系统以及EUDAMED数据库,主要强调了生产企业的医疗器械追溯责任。医疗机构应当对其供应产品的UDI进行电子化存储、记录,UDI将用于报告严重事件以及进行安全纠正措施,旨在加强医疗器械上市后政府对其安全性的有效监管。
目前国家药监局统筹规划建立的医疗器械唯一标识数据库已投入使用,主要用于医疗器械产品标识及相关信息的申报管理、维护和变更,目前登记信息包括产品标识、生产标识、包装标识以及产品本身基本信息、储存或操作信息、临床使用尺寸信息、注册版本更新、注册人联系信息等。医疗器械注册人/备案人应按照相关标准或者规范要求上传、维护和更新唯一标识数据库中的相关数据,UDI数据库通过将相关数据共享给经营企业、医疗机构、主管部门、社会公众,PI、DI共同使用能够实现医疗器械在流通和使用中的识别、记录,实现医疗器械在流通、使用过程中的有效追踪,增强对其安全使用、各监管环节有效监管的整体把控。
主要配套规定
《条例》强调医疗器械注册人、备案人应当建立并执行产品追溯和召回制度;医疗器械经营企业、使用单位应当建立进货查验记录制度。从事第二类、第三类医疗器械批发业务以及第三类医疗器械零售业务的经营企业,应当建立销售记录制度。进货查验记录和销售记录应当真实、准确、完整、可追溯,并按照规定予以保存;对于未按照规定建立并执行产品追溯制度的医疗器械注册人、备案人,《条例》明确了对相关责任主体或负责人员予以警告、罚款、吊销证照等处罚措施。

律师
竞天公诚律师事务所
国家市场监督管理总局和国家卫生健康委员会2018年8月发布的《医疗器械不良事件监测和再评价管理办法》对上市许可持有人、经营企业、使用单位在不良事件评价、控制上进行了规范,其中包括:(1)上市许可持有人应当具有保证医疗器械安全有效的质量管理能力和相应责任能力,建立医疗器械不良事件监测体系;(2)上市许可持有人、经营企业、使用单位应当向医疗器械不良事件监测技术机构(监测机构)直接报告医疗器械不良事件;(3)经营企业、使用单位应当建立本单位医疗器械不良事件监测工作制度,收集医疗器械不良事件,及时向持有人报告,并按照要求向监测机构报告,并配合不良事件评价、调查工作;(4)医疗机构还应当将医疗器械不良事件监测纳入医疗机构质量安全管理重点工作,配备与其经营或者使用规模相适应的机构或者人员从事医疗器械不良事件监测相关工作。
其他部门规范性文件包括一系列医疗器械生产质量管理规范要求医疗器械生产企业建立产品销售记录,并满足可追溯的要求。销售记录至少包括医疗器械的名称、规格、型号、数量;生产批号、有效期、销售日期、购货单位名称、地址、联系方式等内容。UDI规则进一步明确注册人/备案人负责按照该规则创建和维护医疗器械唯一标识,在产品或者包装上赋予医疗器械唯一标识数据载体,上传相关数据,利用医疗器械唯一标识加强产品全过程管理。鼓励医疗器械生产经营企业和使用单位积极应用医疗器械唯一标识进行相关管理。
监管重点
近期境外上市的企业对于该问题的描述主要体现在招股书业务章节以及监管章节中对不同国家或地区的UDI相关制度进行一般性概括说明。
结合近期申请A股上市的医疗器械生产、经营企业的监管问询及反馈回复,笔者整理出以下几点监管重点关注问题。
企业可否实现全流程追溯?该提问体现了监管机构对于医疗器械生产企业能否有效把控产品流向的关注,对于中介机构而言,主要核查方法包括:
(1)梳理相关法规以及发行人内部制度,是否建立医疗器械唯一批号,生产过程以及销售阶段是否能够追溯到产品的原材料、加工设备、检测设备、生产检验人员、销售流向,是否已通过相关制度性文件以及设置相关专职人员实现产品追踪;
(2)核查合同文本,是否设置产品追溯的相关条款,其中重点关注对产品责任的约定,是否有业务部门人员负责统计产品销售数据、信息。
可否获取最终销售情况?发行人及相关责任主体在产品生产、流通、使用过程中能否保障医疗器械的安全性是监管机构关心的问题。除上文介绍的一般核查手段之外,对于该问题应当还结合实践中经营企业以及医疗机构的反馈报告及使用信息、不良事件监测,通过经营企业以及医疗机构、监测机构追溯产品临床动态。
是否符合行业政策及监管要求?该问题同属产品质量范畴,应当关注发行人是否按照相关法规进行UDI产品赋码、标识申报,是否建立健全并有效执行相关制度,是否存在产品召回事件、产品质量事故或纠纷、是否曾接受食药/卫生健康等主管部门检查并发现问题的情况,若发生不良事件,是否实际能够有效追溯产品并有应急处理突发事件的能力。

北京市朝阳区建国路77号
华贸中心3号写字楼34层 邮编: 100025
电话: +86 10 5809 1189
传真: +86 10 5809 1100